日前��,輝瑞(Pfizer)公司在第28屆歐洲皮膚病與性病學(xué)會(EADV)大會上公布��,其JAK1抑制劑abrocitinib���,在治療12歲及以上中重度特應(yīng)性皮炎(AD)患者的3期關(guān)鍵性臨床試驗JADE MONO-1中,達到了主要終點和所有關(guān)鍵性次要終點�。輝瑞公司預(yù)計將在2020年向監(jiān)管機構(gòu)遞交新藥申請。特應(yīng)性皮炎是一種慢性��、復(fù)發(fā)性皮膚病�,主要癥狀為身體任何部位可能出現(xiàn)嚴(yán)重瘙癢、皮膚干裂和炎癥����。中重度特應(yīng)性皮炎患者因為嚴(yán)重瘙癢可能導(dǎo)致皮膚損傷和失眠。如同其它慢性炎癥性疾病一樣���,特應(yīng)性皮炎也是免疫系統(tǒng)介導(dǎo)的疾病�����,免疫細胞和炎癥性細胞因子之間的復(fù)雜互動在疾病發(fā)生方面起到重要作用�。作為最常見的慢性皮炎之一,它在世界范圍內(nèi)影響高達20%的兒童患者和10%的成年患者�。而且在這些兒童患者里,有約一半會出現(xiàn)癥狀的反復(fù)�。因此,他們需要一款新型藥物來控制他們的病情�����。
輝瑞的abrocitinib是一種口服小分子特異性JAK1抑制劑���。JAK1抑制劑通過調(diào)節(jié)多種與特應(yīng)性皮炎病理相關(guān)的細胞因子來控制病情,包括白細胞介素IL-4�,IL-13,IL-31和干擾素γ����。之前,abrocitinib已經(jīng)獲得美國FDA授予的突破性療法認(rèn)定��。
▲Abrocitinib的分子結(jié)構(gòu)式(圖片來源:ChemIDplus)該項名為JADE MONO-1的試驗是一項隨機����,雙盲��,含安慰劑對照的3期臨床研究�����,旨在評估abrocitinib對12歲及以上中重度特應(yīng)性皮炎患者的有效性和安全性�。參與該試驗的387名患者被隨機分配接受每日一次200毫克或100毫克的abrocitinib或安慰劑的治療����。試驗結(jié)果表明,治療12周后��,與安慰劑組相比����,分別有43.8%和23.7%的患者皮膚癥狀達到或接近完全消失(IGA評分0/1),而在安慰劑組的數(shù)值為7.9%���。而且���,在治療組中,分別有62.7%和39.7%的患者的濕疹面積和嚴(yán)重程度指數(shù)比基線改變至少75%(EASI 75)��,而安慰劑組中這一數(shù)值只有11.8%,達到試驗的主要療效終點�����。
值得一提的是�����,美國FierceBiotech網(wǎng)站上發(fā)布的文章指出�,該試驗治療組中57.2%的患者(200毫克劑量組)的瘙癢數(shù)字評定量表(NRS)評分至少提高四分,高于另一款生物制劑dupilumab在治療16周后達到這一效果的患者比例���,abrocitinib在患者的止癢方面可能具有潛在的優(yōu)勢����。此外�����,abrocitinib還在該試驗中達到了EASI 90等其它關(guān)鍵性次要終點��。
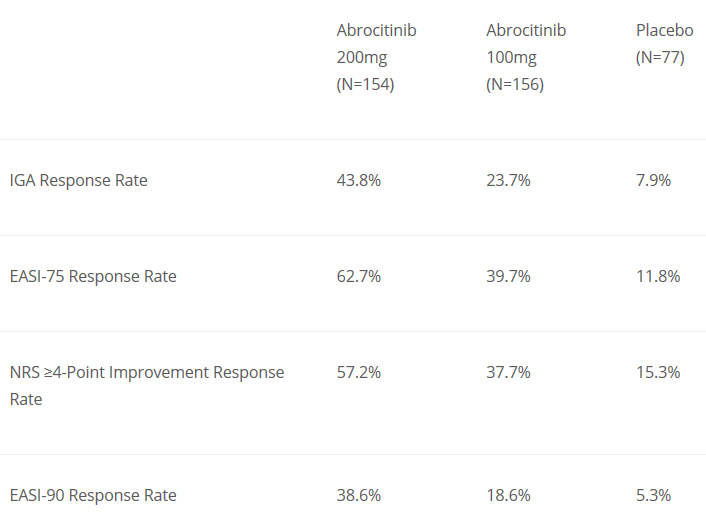
▲在JADE MONO-1試驗中��,abrocitinib達到主要終點和關(guān)鍵性次要終點的患者比例
“中重度特應(yīng)性皮炎患者非常需要有效的治療方案來改善他們的病情�,”輝瑞全球產(chǎn)品開發(fā)部炎癥與免疫學(xué)首席開發(fā)官Michael Corbo博士說:“治療中重度特應(yīng)性皮炎的兩項關(guān)鍵性3期臨床試驗的積極結(jié)果證明了abrocitinib在改善患者病情方面的潛力。如果獲得批準(zhǔn)����,abrocitinib可能成為這些患者的首款每日口服一次的治療選擇?����!?/span>
參考資料:
[1] Pfizer Presents Positive Phase 3 Data at the 28th Congress of the European Academy of Dermatology and Venereology for Abrocitinib in Moderate to Severe Atopic Dermatitis, Retrieved October 14, 2019, from https://www.pfizer.com/news/press-release/press-release-detail/pfizer_presents_positive_phase_3_data_at_the_28th_congress_of_the_european_academy_of_dermatology_and_venereology_for_abrocitinib_in_moderate_to_severe_atopic_dermatitis
[2] Pfizer posts detailed phase 3 data on its Dupixent rival, Retrieved October 14, 2019, from https://www.fiercebiotech.com/biotech/pfizer-posts-detailed-phase-3-data-its-dupixent-rival



