根據(jù)中國國家藥監(jiān)局藥品審評中心(CDE)網(wǎng)站最新公示�,Incyte與信達(dá)生物聯(lián)合提交的成纖維細(xì)胞生長因子受體(FGFR)抑制劑pemigatinib片���、PI3Kδ抑制劑parsaclisib片臨床試驗(yàn)申請已獲得默示許可�����。其中pemigatinib適應(yīng)癥為膽管癌,parsaclisib片適應(yīng)癥為復(fù)發(fā)/難治濾泡性淋巴瘤和邊緣區(qū)淋巴瘤�����。至此,Incyte與信達(dá)這對“CP”聯(lián)合開發(fā)的三款藥中�,已經(jīng)有兩款在中國獲批臨床����。還有一款JAK1抑制劑itacitinib的臨床申請已于今年8月獲得CDE受理�。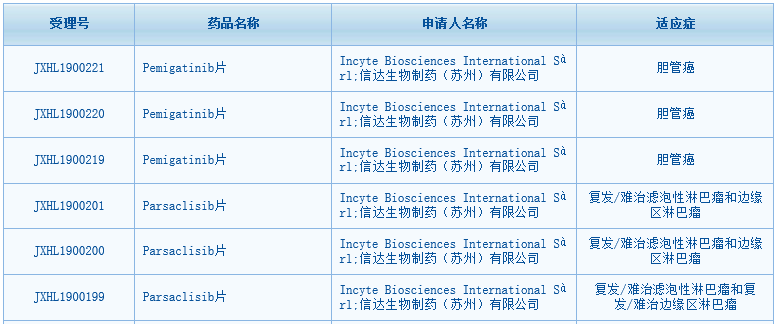
▲pemigatinib片和parsaclisib片獲批臨床(圖片來源:CDE官網(wǎng))Pemigatinib�����、parsaclisib和JAK1抑制劑itacitinib均由Incyte發(fā)現(xiàn)和開發(fā)����,2018年12月��,信達(dá)生物以高達(dá)約3.9億美元(含4000萬美元首付款)的總金額獲得了這三款在研候選藥物針對血液病和腫瘤適應(yīng)癥在大中華區(qū)(含中國大陸及港澳臺(tái)地區(qū))的開發(fā)和商業(yè)化權(quán)利。合作達(dá)成后�����,Incyte與信達(dá)生物快速推進(jìn)這三款藥物在中國的臨床申報(bào)。截至目前���,雙方已經(jīng)在中國提交了涉及這三種藥物的共計(jì)10項(xiàng)臨床試驗(yàn)申請。
Pemigatinib是一款針對FGFR亞型1/2/3的強(qiáng)效選擇性口服抑制劑����。FGFR在腫瘤細(xì)胞增殖、存活���、遷移和血管生成(新血管的形成)中發(fā)揮重要作用�����,F(xiàn)GFR基因融合/重排�����、易位和擴(kuò)增極可能導(dǎo)致多種癌癥的發(fā)生�。在美國���,pemigatinib已獲得突破性療法認(rèn)定�,用于治療既往經(jīng)治的晚期/轉(zhuǎn)移性或不可切除的FGFR2基因易位型膽管癌。在今年10月召開的2019年歐洲腫瘤內(nèi)科學(xué)會(huì)(ESMO)上�����,Incyte 公布了pemigatinib治療復(fù)發(fā)晚期膽管癌患者的2期臨床試驗(yàn)結(jié)果:在既往經(jīng)治的局部晚期或轉(zhuǎn)移性膽管癌伴FGFR2基因融合或重排的患者中���,pemigatinib單藥治療后的總體緩解率(ORR)為36%(主要終點(diǎn))����,疾病控制率(DCR)達(dá)82%���,中位緩解持續(xù)時(shí)間(DOR)達(dá)7.5個(gè)月,中位無進(jìn)展生存期(PFS)為6.9個(gè)月(次要終點(diǎn))�����,且總體耐受性良好����。膽管癌是一種發(fā)生于膽管的惡性腫瘤,根據(jù)其起源部位可以分為肝內(nèi)膽管癌和肝外膽管癌�。膽管癌患者通常在診斷時(shí)已處于疾病后期或晚期����,但是對于晚期膽管癌���,目前沒有獲批的全身性療法��,患者的化療選擇也非常有限�,預(yù)后較差���。Parsaclisib是針對PI3Kδ的新型口服抑制劑,對于抑制PI3Kδ在惡性B細(xì)胞淋巴瘤的生長�����、存活中起到重要作用�。在臨床前研究中,parsaclisib展現(xiàn)出了高選擇性和有效性�,這意味著該藥有潛力為淋巴瘤及其它惡性血液腫瘤患者提供臨床獲益。目前�����,Incyte公司正在中國境外開展CITADEL系列的2期臨床研究,以探索該產(chǎn)品針對非霍奇金淋巴瘤的療效和安全性�����。此外���,parsalisib在骨髓纖維變性�、局部晚期或轉(zhuǎn)移的實(shí)體瘤以及彌漫性大B細(xì)胞淋巴瘤里均開展了相應(yīng)的1期和2期臨床研究�����。
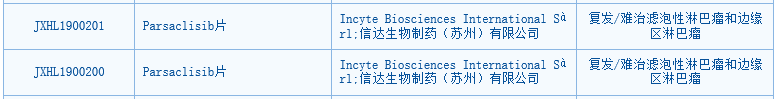
▲parsalisib獲批臨床(圖片來源:CDE官網(wǎng))今年8月��,parsaclisib的臨床試驗(yàn)申請獲得中國國家藥監(jiān)局藥品審評中心(CDE)受理��,并于近日獲得臨床試驗(yàn)?zāi)驹S可����。Itacitinib是新型���、高效��、選擇性抑制JAK1信號通路的小分子抑制劑���,該藥的臨床試驗(yàn)申請已于今年8月獲得CDE受理。根據(jù)Incyte公司今年發(fā)布的二季度報(bào)告��,itacitinib目前正在開展兩項(xiàng)針對移植物抗宿主病的3期臨床試驗(yàn)�����,并完成了該藥與EGFR抑制劑奧希替尼組合二線治療EGFR突變陽性非小細(xì)胞肺癌(NSCLC)的1/2期臨床研究����。我們祝賀Incyte與信達(dá)生物聯(lián)合開發(fā)的FGFR抑制劑pemigatinib、PI3Kδ抑制劑parsaclisib在中國獲批臨床�����,希望它們的臨床試驗(yàn)?zāi)軌蝽樌_展并取得好的結(jié)果�����,早日為患者帶來更多的治療選擇��!





