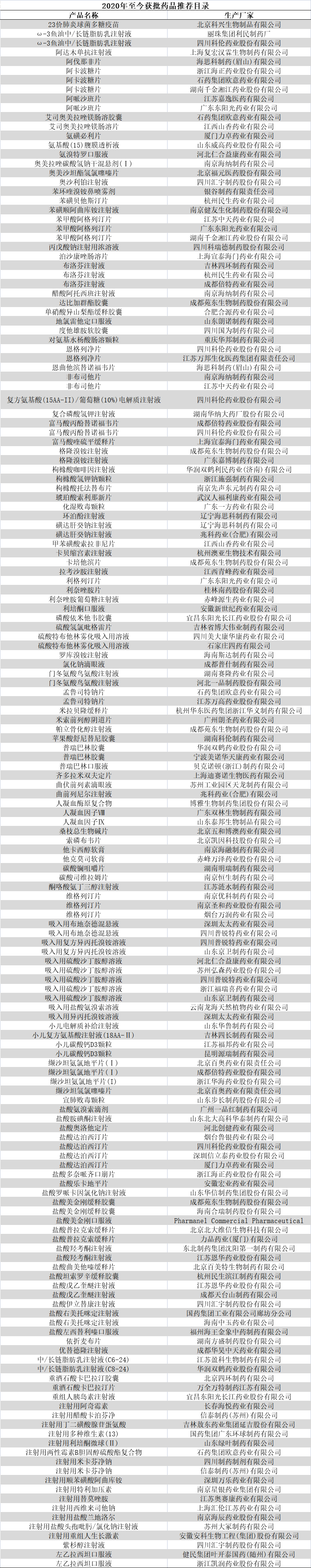
5月10日, 第三十八屆中國醫(yī)藥產(chǎn)業(yè)發(fā)展高峰論壇在上海召開,知名專家在會上表示:今后5年預計將有300個以上新藥申報NDA/BLA���。而十三五申報的新藥已經(jīng)超過1000個,今后每年20個�,將進入新藥密集上市的階段。(第38屆中國醫(yī)藥產(chǎn)業(yè)發(fā)展高峰論壇)根據(jù)統(tǒng)計��,2019年醫(yī)藥制造業(yè)規(guī)模以上企業(yè)研發(fā)投入609.6億元�,研發(fā)強度達到2.55%����。由于大量研發(fā)型小企業(yè)未納入統(tǒng)計范圍�,估計全行業(yè)年研發(fā)投入已達1500億元以上。2016-2020年的“十三五”期間�����,藥審中心受理創(chuàng)新藥注冊申請數(shù)量呈穩(wěn)步上升趨勢����。2016年�����,藥審中心共受理化藥創(chuàng)新藥注冊申請90個品種�,2017年上升為149個。2018年�����,中國創(chuàng)新藥更是按下“快進鍵”��,受理1類創(chuàng)新藥注冊申請264個��,2019年上升為319個,2020年為901個�。2008-2018年,中國誕生了41個1類新藥��,僅2018年一年新增10個���。2019年中國新增1類新藥12個���,2020年新增15個,中國藥物創(chuàng)新能力在“十三五”的后三年有了巨大的進步����。2020年,共有18家biotech首次上市或二次上市�����。2018年以來隨著尚無盈利的生物科技公司大量登陸港交所和科創(chuàng)板�,目前已有超過30家biotech在A股和港股上市交易。未來���,Biotech批量上市將繼續(xù)成為常態(tài)��。西南證券分析�,未來5年上市的創(chuàng)新藥企有望擴容到100家左右,再加上部分有望實現(xiàn)創(chuàng)新升級轉型的傳統(tǒng)藥企����,創(chuàng)新藥將不斷豐富。據(jù)Insights數(shù)據(jù)分析�����,中國已迅速成為全球最大的生物醫(yī)藥和醫(yī)療器械市場之一�����,預計2022年銷售額將達到1,450億至1,750億美元���。從歷史數(shù)據(jù)看,進口創(chuàng)新藥獲準進入中國平均要延遲5至7年����,主要由于審查進程緩慢及本地要求繁瑣,例如在境外第二階段研究完成之前禁止開始本地研發(fā)���。2017年�,國家食品藥品監(jiān)督管理總局(CFDA)宣布了一系列加快創(chuàng)新藥營銷授權的監(jiān)管改革措施����,其中包括快速審批流程和豁免罕見疾病用藥或有大量需求藥品的本地研發(fā)���。此后,國家陸續(xù)出臺多項政策推進創(chuàng)新藥的審批速度����。2018年5月17日,國家藥監(jiān)局會同衛(wèi)生健康委發(fā)布《關于優(yōu)化藥品注冊審評審批有關事宜的公告》���,大幅簡化境外上市新藥審批程序�。申請人無需申報臨床試驗�,可直接以境外試驗數(shù)據(jù)申報上市,藥品上市時間將加快1-2年����。2019年醫(yī)保目錄調整中,70個新藥通過談判被納入國家醫(yī)保藥品目錄����,談判成功的藥品多為近年來新上市且具有較高臨床價值的藥品。2020年9月18日�,國家醫(yī)保局發(fā)布的《2020年國家醫(yī)保藥品目錄調整通過形式審查的申報藥品名單》中,有171種藥品是在2015年1月1日至2020年8月17日期間獲批上市的新藥。醫(yī)保支持藥品創(chuàng)新的明確信號正不斷釋放�。據(jù)了解,國家藥監(jiān)局正在努力加快審批工作�����,且審批隊伍也在迅速擴大���,人數(shù)已過千人�,而此前2014年只有不到100人����。此前,在國新辦就降低抗癌藥品費用有關情況舉行新聞發(fā)布會上��,國家藥品監(jiān)管局藥化注冊司副司長李金菊給出了一系列數(shù)據(jù):2017年�,申報臨床試驗的抗癌藥品279個,比2014年的155個增長了80%�����;批準上市抗癌藥品29個����,比2014年的24個增長20%;批準進口抗癌藥品19個�,比2014年的5個增長280%。在一系列政策的支持下��,藥品審評審批不斷提速���,這也將利好藥企增加研發(fā)投入��,釋放創(chuàng)新潛力���,提升創(chuàng)新能力。創(chuàng)新藥是企業(yè)發(fā)展重點中國的制藥工業(yè)從仿制藥起家��,隨著政策和時代的變化���,從品牌仿制藥逐步朝創(chuàng)新藥方向進行演進�����。當前國內的創(chuàng)新藥市場份額占比和發(fā)達國家相比差距十倍����,主要由于醫(yī)保對于創(chuàng)新藥的支持力度不夠�����,以及受到藥占比考核等政策的制約。近年隨著國內醫(yī)療改革的不斷推進����,各種限制因素逐步改善,將從需求側不斷提升國內創(chuàng)新藥的需求�,提升市場份額占比。創(chuàng)新藥研發(fā)是一個高投入��、高風險����、高回報的事業(yè),對于創(chuàng)新藥企而言�����,如果想要取得長期的成功�,既需找對合適的研發(fā)方向,又要具備強大的資金����、人才和同業(yè)合作能力�。 隨著行業(yè)趨勢和政策的推動,國內越來越多的藥企開始發(fā)展創(chuàng)新藥。此前���,華森制藥發(fā)布公告宣布進行新的組織架構調整�。公告顯示�����,為適應公司業(yè)務發(fā)展的需要��,進一步完善公司治理結構����,提升公司運營效率和管理水平,決定新組建一個創(chuàng)新藥事業(yè)部����,主要負責公司創(chuàng)新藥板塊的統(tǒng)籌管理工作。而作為創(chuàng)新藥行業(yè)的龍頭企業(yè)��,恒瑞醫(yī)藥經(jīng)過多年的發(fā)展�����,已經(jīng)打造出了一支擁有4700多人的研發(fā)團隊���,在2020年報中�����,恒瑞醫(yī)藥研發(fā)投入近50億元���,獲82個創(chuàng)新藥臨床批件�����。在收入結構中�,腫瘤藥占比55%�,達到152.68億元,同比增長44.36%����。近幾年來,國內涌現(xiàn)了眾多仿制藥和生物類似藥��,在政府的大力支持下��,越來越多的藥品被納入醫(yī)保體系�����。但是,如果一味依賴進口和仿制�����,就只能跟著別人走�����,無法實現(xiàn)超越����。盡管投入成本較大���,但創(chuàng)新藥對企業(yè)的研究意義重大��。一款藥品研發(fā)成功將對企業(yè)帶來豐厚的回報�。同時��,創(chuàng)新藥物研究對我國建設創(chuàng)新型國家具有重大意義���。在國家(2006-2020)的中長期國家科技重大專項中�,專門有“重大新藥創(chuàng)制專項”����,目的是創(chuàng)制一批重大疾病具有較好治療作用��,具有自主知識產(chǎn)權的藥物�����,降低對國外新藥的依賴����。隨著人民生活水平的提高����,人們對健康的要求也越來越高,對新藥物的需求已經(jīng)迫在眉睫�。在國家政策的大力支持下,創(chuàng)新藥領域方興未艾�����,藥企發(fā)展創(chuàng)新藥來增強核心競爭力成為大趨勢���。