時間匆匆易逝,轉(zhuǎn)眼間6月份即將結(jié)束��,在即將過去的6月里���,Nature雜志又有哪些亮點(diǎn)研究值得學(xué)習(xí)呢�?小編對相關(guān)文章進(jìn)行了整理,與大家一起學(xué)習(xí)�!
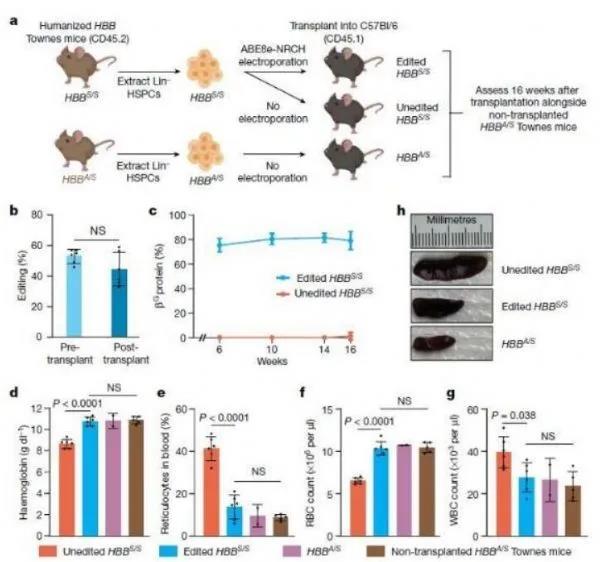
【1】Nature:重大進(jìn)展!利用堿基編輯讓致病性血紅蛋白無害化�����,有望治療鐮狀細(xì)胞病
doi:10.1038/s41586-021-03609-w在一項(xiàng)新的研究中��,由來自美國布羅德研究所和圣猶大兒童研究醫(yī)院的研究人員領(lǐng)導(dǎo)的一個研究團(tuán)隊(duì)證實(shí)一種堿基編輯方法能夠高效地校正患者造血干細(xì)胞中和小鼠體內(nèi)導(dǎo)致SCD的基因突變�����。這種基因編輯治療利用堿基編輯將致病性的血紅蛋白基因轉(zhuǎn)化為良性的基因變體�,挽救了SCD動物模型中的疾病癥狀,使健康的血細(xì)胞得以持久地產(chǎn)生����。相關(guān)研究結(jié)果于2021年6月2日在線發(fā)表在Nature期刊上,論文標(biāo)題為“Base editing of haematopoietic stem cells rescues sickle cell disease in mice”�。SCD的根源是患者攜帶血紅蛋白基因HBB的兩個突變拷貝。這兩個突變拷貝導(dǎo)致紅細(xì)胞從圓盤狀轉(zhuǎn)變?yōu)殓牭稜?����,引發(fā)一連串事件�,最終導(dǎo)致器官損傷、復(fù)發(fā)性疼痛和早期死亡。在這項(xiàng)研究中����,這些作者使用了一種稱為堿基編輯的分子技術(shù),在人類造血干細(xì)胞中和SCD小鼠模型體內(nèi)直接將致病性的HBB基因(HBBS)轉(zhuǎn)換成無害的望加錫(Makassar)HBB基因變體(HBBG)���。HBBS→HBBG堿基編輯減輕小鼠SCD模型的病理�����。圖片來自Nature, 2021, doi:10.1038/s41586-021-03609-w��。最后�,為了證實(shí)目標(biāo)造血干細(xì)胞遭受持久編輯�����,這些作者進(jìn)行了二次移植:從16周前接受過堿基編輯的造血干細(xì)胞移植的小鼠中抽取骨髓�,隨后將骨髓中的造血干細(xì)胞轉(zhuǎn)移到一組新的小鼠體內(nèi)�。在這個新的小鼠隊(duì)列中,經(jīng)過堿基編輯的造血干細(xì)胞繼續(xù)與健康的造血干細(xì)胞表現(xiàn)相似�,從而證實(shí)了堿基編輯的效果是持久的。他們還證實(shí)��,對至少20%的致病性HBB基因進(jìn)行堿基編輯足以將SCD小鼠模型的血液指標(biāo)維持在健康水平。
【2】Nature:新發(fā)現(xiàn)����!科學(xué)家揭示有效預(yù)防癌癥轉(zhuǎn)移的新機(jī)制!doi:10.1038/s41586-021-03614-z原發(fā)性腫瘤切除后無法檢測到播散性腫瘤細(xì)胞(DTCs���,disseminated tumour cells)的持續(xù)存在對于開發(fā)有效的癌癥療法構(gòu)成了巨大的挑戰(zhàn)��,這些持久休眠的DTCs是癌癥未來發(fā)生轉(zhuǎn)移的種子�,而將其從休眠狀態(tài)轉(zhuǎn)化為生長狀態(tài)的特殊機(jī)制目前還需要研究人員闡明�。由于癌癥的休眠能為預(yù)防轉(zhuǎn)移性疾病的發(fā)生提供一種獨(dú)特的治療窗口,因此研究人員就需要全面理解休眠狀態(tài)的DTCs的分布�����、組成和儲存的動態(tài)學(xué)變化��。即使表面上癌癥療法成功治療后多年��,癌癥依然會在體內(nèi)開始復(fù)發(fā)���,癌細(xì)胞會從原發(fā)性位點(diǎn)遷移到其它機(jī)體器官���,并以休眠狀態(tài)存活較長時間���,近日,一篇發(fā)表在國際雜志Nature上題為“Hepatic stellate cells suppress NK cell-sustained breast cancer dormancy”的研究報(bào)告中����,來自巴塞爾大學(xué)醫(yī)學(xué)院等機(jī)構(gòu)的科學(xué)家們就通過研究揭示了這些休眠細(xì)胞是如何保持休眠狀態(tài),以及其是如何蘇醒并形成致死性癌癥轉(zhuǎn)移的��。腫瘤或許會在宿主體內(nèi)留下不祥的“遺產(chǎn)”�����,即癌細(xì)胞能從腫瘤遷移到機(jī)體其它位點(diǎn)�,并在新位點(diǎn)以一種休眠的狀態(tài)來生存;目前��,癌癥醫(yī)學(xué)研究依賴于在患者接受初次療法后對其進(jìn)行監(jiān)測����,旨在檢測能形成轉(zhuǎn)移的癌細(xì)胞�,而癌癥研究中的其中一個最大的問題就是到底是什么樣的機(jī)制促成了這種轉(zhuǎn)變呢?研究者Bentires-Alj表示���,本文研究結(jié)果提高了我們開發(fā)新型免疫療法的希望�����,新型療法或?qū)攸c(diǎn)關(guān)注自然殺傷細(xì)胞�,并將其作為預(yù)防性策略來治療有可能會引發(fā)轉(zhuǎn)移的攜帶休眠癌細(xì)胞的患者。在通往既定療法的漫長道路上����,研究人員將會繼續(xù)研究證明刺激自然殺傷細(xì)胞就能預(yù)防人類患者機(jī)體中癌癥發(fā)生轉(zhuǎn)移,目前他們正在通過聯(lián)合研究來攻克這一難題�。自然殺傷細(xì)胞是預(yù)防癌癥發(fā)生肝臟轉(zhuǎn)移的天然屏障,如果其也能被用來預(yù)防癌細(xì)胞在機(jī)體其它部位的轉(zhuǎn)移�����,那么或許就有可能永久預(yù)防癌癥發(fā)生復(fù)發(fā)�����,目前研究人員正在其它轉(zhuǎn)移性位點(diǎn)研究諸如此類機(jī)制����,并取得了非常可喜的成果���。綜上����,本文研究中,研究人員識別出了自然殺傷細(xì)胞和激活的肝星狀細(xì)胞之間的相互作用或能作為癌癥休眠的主開關(guān)�,結(jié)果表明,旨在讓自然殺傷細(xì)胞池正?����;寞煼ɑ蚨寄艹晒σ种瓢┘?xì)胞在宿主機(jī)體內(nèi)的轉(zhuǎn)移性生長���。【3】Nature:開發(fā)出一種名為Red2Onco的多色報(bào)道模型來追蹤腸道干細(xì)胞生境的致癌驅(qū)動重塑機(jī)制doi:10.1038/s41586-021-03605-0腫瘤細(xì)胞和周圍微環(huán)境之間的相互作用會促進(jìn)腫瘤進(jìn)展�、轉(zhuǎn)移和復(fù)發(fā)�,盡管對果蠅的鑲嵌分析能幫助研究人員理解這種相互作用,但在脊椎動物機(jī)體中設(shè)計(jì)出平行的研究方法依然比較困難�;日前,一篇發(fā)表在國際雜志Nature上題為“Tracing oncogene-driven remodelling of the intestinal stem cell niche”的研究報(bào)告中��,來自劍橋大學(xué)等機(jī)構(gòu)的科學(xué)家們通過研究開發(fā)出了一種創(chuàng)新性的遺傳小鼠模型—Red2Onco���,其就能幫助檢測誘發(fā)癌癥的最初步驟���,Red2Onco的多色標(biāo)記系統(tǒng)能在單細(xì)胞水平上追蹤第一次癌變打擊后機(jī)體腸道中腫瘤的進(jìn)展程度����。對癌癥的研究一直受到了細(xì)胞轉(zhuǎn)變成為臨床可檢測的閾值的限制��;然而���,通過惡性腫瘤的最初階段在組織學(xué)上往往是看不見的,因?yàn)檫@一過程源于單一細(xì)胞����,在早期階段,一種所謂的“播種細(xì)胞”的過程能獲得最初的促癌突變��,這也被稱為“第一次致癌打擊”���,同時會被正常的組織完全圍繞�;為了克服這種障礙�,文章中,研究人員就開發(fā)了一種實(shí)驗(yàn)室系統(tǒng)來解析直到現(xiàn)在科學(xué)家們?nèi)匀晃窗l(fā)現(xiàn)的癌前病變步驟�����。研究者Bon-Kyoung Koo說道����,隨著諸如深度靶向性DNA測序技術(shù)的進(jìn)展���,如今科學(xué)家們已經(jīng)注意到了與癌癥相關(guān)的突變也會出現(xiàn)在正常組織中;而這是非?����?膳碌?��;這一轉(zhuǎn)折點(diǎn)就像偵探一樣�,開始追蹤第一個致癌打擊�。由于大多數(shù)人類癌癥類型都源于上皮細(xì)胞�����,于是研究人員就決定建立一種遺傳模型來分析小鼠機(jī)體腸道中首個致癌轉(zhuǎn)化所產(chǎn)生的影響。這種名為Red2Onco的遺傳模型是一種多色標(biāo)記技術(shù)�����,其能幫助追蹤從單一突變細(xì)胞開始的腫瘤進(jìn)展過程�����。在Red2Onco的幫助下,研究人員發(fā)現(xiàn)����,突變的細(xì)胞能為其鄰近的非突變細(xì)胞創(chuàng)造一種敵對的環(huán)境���,并大規(guī)模地解除對小鼠腸道組織中正常干細(xì)胞生境的調(diào)節(jié)�,這是迄今為止研究人員所嘗試的最讓他們興奮的方法了����。非小細(xì)胞肺癌中巨噬細(xì)胞的分布特性。圖片來源:Casanova-Acebes, M., et al. Nature (2021). doi:10.1038/s41586-021-03651-8【4】Nature:早期肺癌細(xì)胞或會“拉攏”免疫細(xì)胞來幫助腫瘤入侵肺部組織
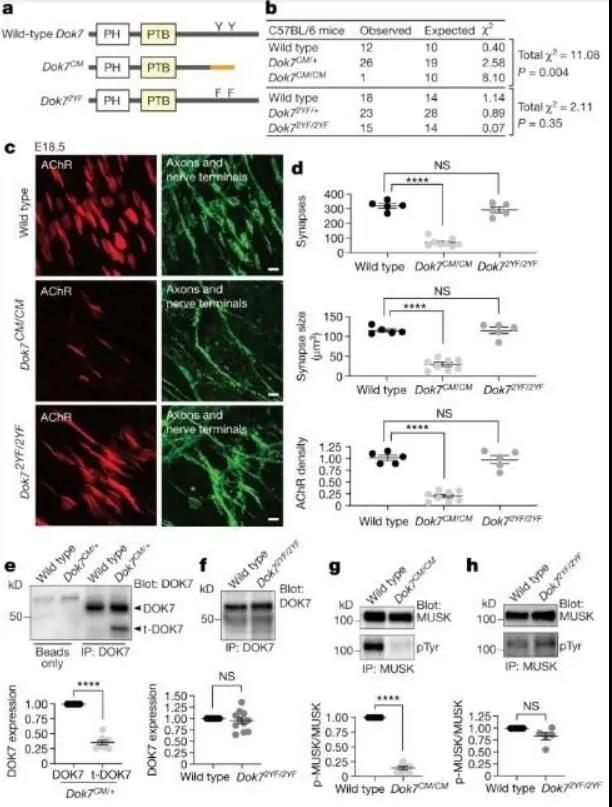
doi:10.1038/s41586-021-03651-8巨噬細(xì)胞在塑造腫瘤微環(huán)境����、腫瘤免疫力以及對免疫療法反應(yīng)上扮演著關(guān)鍵角色,同時其也是開發(fā)新型癌癥療法的重要靶點(diǎn)�����;然而�,調(diào)控巨噬細(xì)胞是非常困難的,因?yàn)槟壳把芯咳藛T缺少對腫瘤巨噬細(xì)胞區(qū)室分子和功能多樣性的理解�����,巨噬細(xì)胞產(chǎn)生于兩個不同的譜系,組織駐留的巨噬細(xì)胞能在局部自我更新�,其并不依賴于成體的造血過程,而短命的單核細(xì)胞衍生的巨噬細(xì)胞則來自成體造血干細(xì)胞���,其會主要集中在炎性病灶中��,目前研究人員并不清楚這些巨噬細(xì)胞譜系是如何促進(jìn)腫瘤微環(huán)境和癌癥進(jìn)展的��。近日�����,一篇發(fā)表在國際雜志Nature上題為“Tissue-resident macrophages provide a pro-tumorigenic niche to early NSCLC cells”的研究報(bào)告中��,來自西奈山伊坎醫(yī)學(xué)院等機(jī)構(gòu)的科學(xué)家們通過研究發(fā)現(xiàn)��,當(dāng)癌癥開始在肺部組織中形成時��,通過用于修復(fù)機(jī)體組織的免疫細(xì)胞就會被腫瘤所“愚弄”�,轉(zhuǎn)而幫助腫瘤使其變得更具侵襲性�。這項(xiàng)研究中,研究人員對來自35名患者機(jī)體肺癌腫瘤和周圍肺部組織樣本進(jìn)行研究����,揭示了巨噬細(xì)胞在腫瘤發(fā)生過程中所扮演的關(guān)鍵角色����。醫(yī)學(xué)博士Miriam Merad表示���,我們設(shè)計(jì)了一項(xiàng)綜合性的研究�����,即從患者進(jìn)入手術(shù)室切除癌癥病灶開始,隨后在細(xì)胞水平下分析患者的肺部腫瘤樣本�、健康肺部組織周圍的樣本以及血液樣本,從而繪制出其所包含的免疫系統(tǒng)組分的圖譜��。【5】Nature揭示:Ω-3脂肪酸跨越血腦屏障進(jìn)行運(yùn)輸?shù)慕Y(jié)構(gòu)基礎(chǔ)doi:10.1038/s41586-021-03650-9二十二碳六烯酸(docosahexaenoic acid)是一種對神經(jīng)系統(tǒng)發(fā)育和功能非常重要的Ω-3脂肪酸��,其主要是通過飲食來源從而供給給大腦和眼睛�,這種營養(yǎng)物質(zhì)能以溶血卵磷脂的形式被運(yùn)輸通過血腦屏障和血液視網(wǎng)膜屏障,整個運(yùn)輸過程則是被主要促進(jìn)超家族結(jié)構(gòu)域2A(MFSD2A)以一種Na+依賴性的方式來完成的�����。近日���,一篇發(fā)表在國際雜志Nature上題為“Structural basis of omega-3 fatty acid transport across the blood–brain barrier”的研究報(bào)告中�,來自哥倫比亞大學(xué)等機(jī)構(gòu)的科學(xué)家們通過研究發(fā)現(xiàn),Ω-3脂肪酸有望作為打開機(jī)體血腦屏障的關(guān)鍵�����。在該地圖中�����,研究人員就能構(gòu)建一種蛋白質(zhì)的3D模型���,并將每個原子都放在其該在的位置上����,于是這或許就讓研究人員想起了解開拼圖的過程���;近年來�����,該項(xiàng)技術(shù)在可視化生物學(xué)分子研究方面已經(jīng)變得非常強(qiáng)大了����。研究者Cater表示�����,我們的研究結(jié)果顯示,MFSD2A有一種碗狀結(jié)構(gòu)����,而Ω-3能結(jié)合到碗中的特定位點(diǎn)上;一般而言碗是倒置的�,其會面向細(xì)胞內(nèi)部,但這僅僅是該蛋白的一個3D快照圖像��,為了確切理解其發(fā)揮作用的分子機(jī)制�,研究人員就需要多個不同角度的快照��,或者更好的運(yùn)輸時的電影圖像�����。為了理解這些運(yùn)動可能是什么樣子�����,研究人員利用蛋白質(zhì)的3D模型作為研究起點(diǎn)來進(jìn)行計(jì)算模擬��,并揭示轉(zhuǎn)運(yùn)蛋白是如何移動并適應(yīng)其形狀��,從而將Ω-3脂肪酸釋放到大腦中的。文章中�,研究人員通過聯(lián)合研究證實(shí)了從結(jié)構(gòu)和計(jì)算模擬中得出的相關(guān)假設(shè),揭示了MFSD2A是如何發(fā)揮作用來確定重要的特定蛋白部分結(jié)構(gòu)的���。目前研究人員正在調(diào)查分析轉(zhuǎn)運(yùn)蛋白是如何識別來自血液中的Ω-3脂肪酸�,本文研究結(jié)果揭示了MFSD2A運(yùn)輸Ω-3脂肪酸進(jìn)入大腦的方式�,綜上,本文研究結(jié)果揭示了這種非典型主要設(shè)施超家族轉(zhuǎn)運(yùn)蛋白介導(dǎo)血溶性脂質(zhì)進(jìn)入大腦的分子機(jī)制���,同時還有望幫助研究人員開發(fā)新型的可供運(yùn)輸?shù)纳窠?jīng)治療性藥物制劑���。【6】Nature:重磅!科學(xué)家發(fā)現(xiàn)一種能促進(jìn)癌癥發(fā)生的新機(jī)制�����!doi:10.1038/s41586-021-03662-5癌癥的發(fā)展與針對具有內(nèi)在紊亂區(qū)域(IDRs���,intrinsically disordered regions)的蛋白質(zhì)的遺傳異常密切相關(guān)����,在人類血液惡性腫瘤中���,核蛋白(NUP98或NUP214)的反復(fù)性染色體異位會產(chǎn)生一種異常的嵌合體�,該嵌合體會無一例外地保留核蛋白的IDR,即苯丙氨酸和甘氨酸殘基的串聯(lián)分散重復(fù)�,然而,非結(jié)構(gòu)性的IDRs是如何促進(jìn)致癌過程的��,目前研究人員并不清楚�����。近日���,一篇刊登在國際雜志Nature上題為“Phase separation drives aberrant chromatin looping and cancer development”的研究報(bào)告中���,來自北卡羅來納大學(xué)等機(jī)構(gòu)的科學(xué)家們通過研究發(fā)現(xiàn)了一種激活特定基因從而誘發(fā)癌癥的新型機(jī)制��。研究者表示�,能將兩種無關(guān)基因融合在一起的突變或會促進(jìn)一種類似于油和水混合但不融合時所觀察到的過程,這一過程被稱之為液-液相分離����,其發(fā)生在細(xì)胞核中,能促進(jìn)具有多種物理特性的隔間形成���,從而促進(jìn)諸如急性白血病等癌癥的發(fā)生��。研究者Greg Wang博士說道���,相分離及其在癌癥中所扮演的角色一直是科學(xué)家們理解該疾病發(fā)生所缺失的一部分����;本文研究就首次將相分離與癌癥形成聯(lián)系了起來�。這一發(fā)現(xiàn)或許就為一種復(fù)雜的、多步驟的能將生物學(xué)和物理學(xué)聯(lián)系在一起的過程帶來新的見解�,為了幫助揭開這一過程,研究人員在實(shí)驗(yàn)室中對攜帶常見融合基因NUP98-HOXA9的癌細(xì)胞進(jìn)行了相關(guān)研究���,這種反常的融合只存在于發(fā)展為白血病的患者的血細(xì)胞中���。因?yàn)樵谄渌膼盒阅[瘤中也能觀察到相類似的基因融合現(xiàn)象,因此研究人員所闡明的機(jī)制或能幫助解釋其它癌癥類型�。研究者相信本文研究或能幫助開啟新型創(chuàng)新性途徑來幫助攻擊細(xì)胞。DOK7的C末端區(qū)域?qū)τ谕挥|的分化以及維持MUSK的酪氨酸磷酸化非常重要�。圖片來源:Oury, J., et al. Nature (2021).doi:10.1038/s41586-021-03672-3【7】Nature:開發(fā)出有望治療先天性肌無力癥的新型抗體療法
doi:10.1038/s41586-021-03672-3先天性肌無力癥(CM,congenital myasthenia)是一種毀滅性的神經(jīng)肌肉疾病���,而銜接蛋白DOK7的突變是引發(fā)CM的主要原因�����,DOK7對于形成和維持神經(jīng)肌肉突觸至關(guān)重要�����;最常見的致病性突變(DOK71124_1127重復(fù))會截?cái)郉OK7�,從而導(dǎo)致兩個酪氨酸殘基的缺失,這些殘基能被磷酸化修飾并會招募CRK蛋白�,而CRK蛋白則對于在突觸處錨定乙酰膽堿受體至關(guān)重要。近日��,一篇發(fā)表在國際雜志Nature上題為“Mechanism of disease and therapeutic rescue of Dok7 congenital myasthenia”的研究報(bào)告中���,來自紐約大學(xué)Grossman醫(yī)學(xué)院等機(jī)構(gòu)的科學(xué)家們通過研究開發(fā)了一種新型抗體療法�����,該療法或有望將年輕小鼠從CM中解救出來���,而且還能逆轉(zhuǎn)成年小鼠疾病的復(fù)發(fā)���。文章中�����,研究人員揭示了引發(fā)CM病因的新細(xì)節(jié)���,同時也為更好地開發(fā)并指導(dǎo)更具靶向性抗體療法提供了新的思路和研究基礎(chǔ)����。在當(dāng)前研究中�����,患有CM的小鼠并不能產(chǎn)生神經(jīng)-肌肉連接(突觸)���,從而觸發(fā)運(yùn)動所需要的肌肉收縮����,比如呼吸作用等�����,因此患病小鼠在出生后不久就會死亡�����;而患有CM的人類嬰兒往往能存活下來,但卻會面臨嚴(yán)重的終生肌無力��,而目前為數(shù)不多的療法僅能用來部分緩解患者的癥狀���。研究者Steven J. Burden表示����,據(jù)我們所知����,本文研究首次通過靶向性療法完全治療了一種先天性缺陷癥,即通過利用一種促進(jìn)突變基因下游蛋白質(zhì)活性的抗體來恢復(fù)突觸的形成�����。雖然這一策略能直接適應(yīng)于本文所研究的神經(jīng)肌肉疾病患病對象����,但相關(guān)研究結(jié)果表明,對于諸如ALS(肌萎縮性側(cè)索硬化癥)等更為常見的疾病而言����,或許也能應(yīng)用類似的療法進(jìn)行治療。【8】Nature:關(guān)閉關(guān)鍵心臟蛋白MARK4或有望幫助保護(hù)機(jī)體抵御心力衰竭和心臟病發(fā)作doi:10.1038/s41586-021-03573-5心肌梗死(myocardial infarction)是成年人過早死亡的一個主要原因����,心肌梗死后心臟功能受損會導(dǎo)致機(jī)體出現(xiàn)慢性心力衰竭,同時還會伴隨有全身性的健康并發(fā)癥以及較高的死亡率�。為此研究人員就需要開發(fā)出有效的治療性策略來改善心肌梗死后心臟功能的恢復(fù);更具體地來講�����,研究者急需開發(fā)出一類新藥來改善患者機(jī)體心臟心肌細(xì)胞的收縮能力�����,因?yàn)楫?dāng)前可用的影響肌肉收縮的療法往往與收縮性心力衰竭患者較高的發(fā)病率和死亡率有關(guān)����,或者對心力衰竭風(fēng)險(xiǎn)的降低非常有限;微管的去酪氨酸化(detyrosination�,即移除酪氨酸化學(xué)基團(tuán))如今就成為了調(diào)節(jié)心肌細(xì)胞收縮的重要機(jī)制。近日����,一篇發(fā)表在國際雜志Nature上題為“MARK4 controls ischaemic heart failure through microtubule detyrosination”的研究報(bào)告中,來自劍橋大學(xué)等機(jī)構(gòu)的科學(xué)家們通過研究發(fā)現(xiàn)��,關(guān)閉一種關(guān)鍵的心肌蛋白或能為藥物提供一種新方法來幫助抵御心臟病患者發(fā)生心力衰竭。尋找心臟病發(fā)作心臟損傷后能成功改善心臟泵血能力的藥物是科學(xué)家們目前一直迫切研究的方向���,然而��,很多能讓衰竭的心肌強(qiáng)烈收縮的藥物都被認(rèn)為是不安全的��,于是這就給開發(fā)治療心臟病發(fā)作和心力衰竭的新型療法留下了一定的機(jī)會和研究空白��,如今研究人員識別出了一種新型的藥物靶點(diǎn)��,即名為MARK4的特殊蛋白�����。文章中�����,研究人員發(fā)現(xiàn)�,當(dāng)小鼠心臟病發(fā)作后期機(jī)體中MARK4的水平會升高�,當(dāng)將心臟中攜帶MARK4和剔除MARK4的小鼠進(jìn)行對比后,研究者發(fā)現(xiàn)����,不攜帶MARK4的小鼠心臟的泵血能力能提高57%�����,這種保護(hù)作用是在其機(jī)體心臟病發(fā)作后24小時后出現(xiàn)的����,并能夠持續(xù)隨后跟蹤研究的4周時間�����。【9】Nature:從2003年到2019年����,全球陸地蒸散量增加10%doi:10.1038/s41586-021-03503-5蒸散(ET)是從地表散發(fā)的水蒸氣通過植物蒸騰的總通量���,是陸地上全球水循環(huán)的第二大組成部分��,僅次于降水(Pr)�。在不斷變化的氣候下���,全球水循環(huán)量可能會增加����,因而對全球陸地蒸散量的準(zhǔn)確量化十分必要。由于觀測和測量全球尺度的陸地蒸散量難度較大�����,通常使用模型���、遙感來模擬驗(yàn)證����。然而�����,這些方法存在很多不確定性��,如模型結(jié)構(gòu)��、升級到全球水平的觀測結(jié)果準(zhǔn)確性等�����。因而���,全球蒸散量的變化性和趨勢仍不清楚��。近日�����,加州理工學(xué)院的研究學(xué)者在Nature上發(fā)表學(xué)術(shù)論文(A 10 percent increase in global land evapotranspiration from 2003 to 2019)����,該文章基于重力恢復(fù)與氣候試驗(yàn)(GRACE)和GRACE-Follow On(GRACE- FO)衛(wèi)星研究了2003年至2019年期間全球陸地蒸散量�����。從2003年到2019年�����,ET呈顯著正線性增長趨勢(2.30 ± 0.52 mm yr-1)����,全球平均ET量約增加了10 ± 2%。即使考慮輸入數(shù)據(jù)的空白填充和誤差�,這一趨勢依然顯著,這是所有水平衡組分交互作用的結(jié)果:Pr呈正趨勢(1.00 mm yr-1)����,Q呈負(fù)趨勢(-1.01 mm yr-1)���,dS/dt也呈負(fù)趨勢(-0.75 mm yr-1)。同時�����,研究人員分析了ET/Q��,ET/Pr和Q/ Pr比值���,發(fā)現(xiàn)ET/Q和ET/Pr在2003年和2019年之間顯著增加���。其中,ET/Q的增加表明這些水循環(huán)組分的分配發(fā)生了變化�����。Pr也越來越被劃分為ET�,而不是Q,這意味著可用水量降低�。