8 月 16 日��,NMPA 官網(wǎng)顯示���,百濟神州的達妥昔單抗 β 獲批上市��,用于神經(jīng)母細胞瘤����。
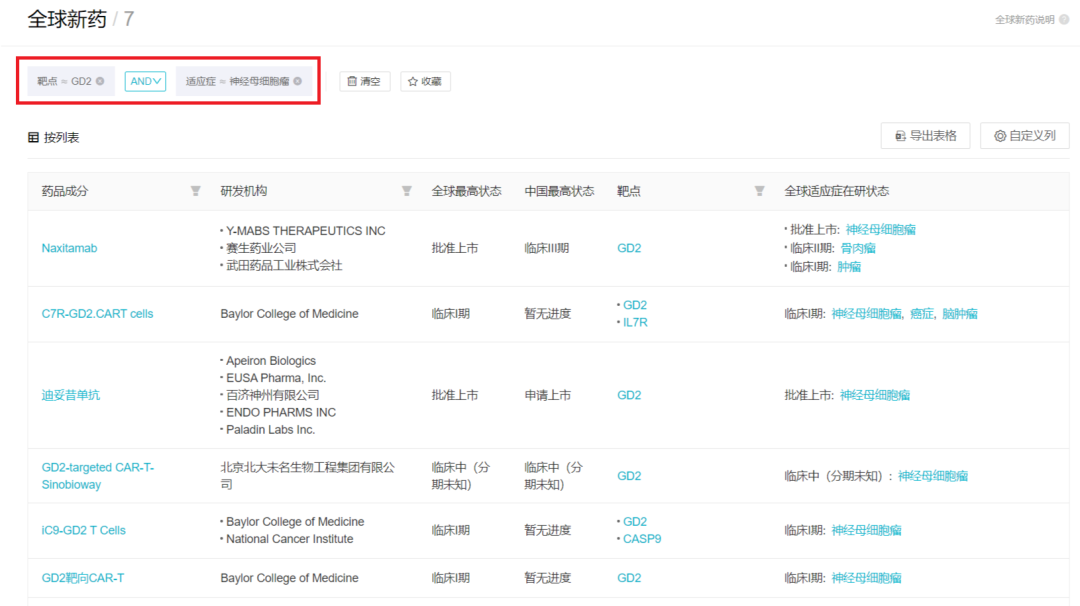
達妥昔單抗 β(Dinutuximab beta)是一款單克隆抗體,可與神經(jīng)母細胞瘤細胞上過度表達的一個 GD2 的特定靶點結合�����。它于 2017 年獲得歐盟委員會批準����,治療 1 歲以上的接受過誘導化療并達到部分緩解的高危神經(jīng)母細胞瘤患者,隨后進行清髓性治療和干細胞移植�,或者復發(fā)或難治性神經(jīng)母細胞瘤的患者。值得一提的是�,達妥昔單抗 β 是歐洲藥品管理局(EMA)唯一批準的用于治療高危神經(jīng)母細胞瘤的靶向腫瘤免疫療法。2020 年 1 月 13 日�,EUSA Pharma(以下簡稱 EUSA)與百濟神州宣布雙方就孤兒生物制劑藥物 SYLVANT?(司妥昔單抗)及 QARZIBA?(dinutuximab beta)在大中華地區(qū)達成獨家開發(fā)和商業(yè)化協(xié)議。同年 11 月����,百濟遞交了達妥昔單抗 β 上市申請并被納入優(yōu)先審評;次年 1 月���,百濟又遞交了司妥昔單抗上市申請被納入優(yōu)先審評。神經(jīng)母細胞瘤是一種交感神經(jīng)系統(tǒng)的惡性腫瘤�,是兒童最常見和最致命的顱外腫瘤,占兒童惡性腫瘤的 8%~10%����;確診時的中位年齡為 17~18 個月�,半數(shù)患者確診時已發(fā)生遠處轉移�。高危神經(jīng)母細胞瘤患兒的預后較差,長期生存率不足 50%���。目前除了手術�、放療外����,用于治療神經(jīng)母細胞瘤的藥物包括化療藥物和免疫治療藥物兩種,治療方案有限��。尤其在國內(nèi)���,針對高危神經(jīng)母細胞瘤的免疫治療藥物如今還尚未獲批�,患者對該類療法的需求還遠遠未能滿足���。根據(jù) Insight 數(shù)據(jù)庫���,在全球范圍內(nèi)靶向 GD2 治療神經(jīng)母細胞瘤的單抗產(chǎn)品也僅有 3 款獲批,前兩款均是來自 EUSA Pharma 的產(chǎn)品�,Dinutuximab 和 Dinutuximab beta (氨基酸序列一致,細胞系不同),它們的獲批使長期缺乏有效療法的兒童高危神經(jīng)母細胞瘤領域獲得了首款免疫療法����。2020 年 11 月 25 日,F(xiàn)DA 通過加速批準途徑批準了 Y-mabs 的那昔妥單抗(Naxitamab)����,賽生藥業(yè)引進了那昔妥單抗,并于 7 月初在國內(nèi)遞交上市申請����。同靶點在研產(chǎn)品中,除了這三款單抗����,另外還有四個項目,均為早期臨床階段的 CAR-T 產(chǎn)品�。來自 Insight 全球新藥庫(http://db.dxy.cn/v5/home/)恭喜迪妥昔單抗獲批上市,期待這款新藥的到來使高危神經(jīng)母細胞瘤患者迎來新的治療選擇��,獲得更長的生存獲益�。